2023.05.19
免疫反應是由多種細胞類型參與的一個受嚴格調控的過程,旨在保護身體免受微生物、毒素的侵害以及避免腫瘤的形成。全球各地的研究人員旨在更深入地了解這些過程,以理解癌癥、自身免疫性疾病、炎癥、過敏和病毒感染背後的機製。實時活細胞動態成像技術正是一種為此提供全面數據的寶貴工具。
本文中,我們使用了新一代活細胞成像系統CELLCYTE X來解決免疫學中的不同問題:觀察不同類型免疫細胞的形態和增殖狀態,記錄巨噬細胞分化過程中的生長行為,進一步討論了CELLCYTE X如何用於分析細胞死亡期間的免疫細胞健康狀況(一種防止免疫系統過度反應的反饋機製),以及利用它來評估細胞免疫療法(如CAR- T療法),以根除癌癥細胞,從而為免疫學研究提供有效的解決方法。
新一代活細胞成像系統 CELLCYTE X
材料與方法
1. 細胞培養
將Jurkat、Nalm-6和THP-1細胞在有10%胎牛血清(FBS)(Sigma)和1%青黴素/鏈黴素(P/S)(Thermo Fisher)的RPMI-1640培養基(Thermo Fisher)中,在37°C和5%CO2下培養。每周傳代兩次,接種用於如下所述研究。
2. 免疫細胞增值研究
將Jurkat、Nalm-6和THP-1細胞重懸、計數並以所示細胞數(2.5k、5k、10k、20k、40k/孔)接種在96孔細胞培養板(Corning,#3595)中。細胞在室溫下沈澱30min,以確保細胞在整個孔中均勻分布。隨後,將細胞培養板置於培養箱中的CELLCYTE X中觀測。使用10X鏡頭標準掃描模塊每2小時掃描一次,監測細胞生長持續96小時。使用CELLCYTE Studio中的細胞融合模塊分析細胞生長情況(圖1)。
3. 巨噬細胞分化研究
將THP-1單核細胞重懸、計數並以每孔10k個細胞接種在96孔細胞培養板中。將12-myristate 13-acetate (PMA) (PeproTech) 以1mg/mL溶解在DMSO中,並將其添加到孔中以獲得5ng/mL、50ng/mL或500ng/mL的最終濃度。濃度為2.5µg/µL 的Lipopolysaccharide(LPS)(Thermo Fisher)作為即用溶液添加到細胞中,以在孔中獲得10ng/µL、100ng/µL.或1000ng/µL的最終濃度。對照細胞不做處理。使用10X標準掃描模塊每3小時對細胞成像,持續96小時。使用CELLCYTE Studio中的細胞融合模塊分析細胞生長情況(圖2)。
4. 活化誘導的細胞死亡研究
將Jurkat細胞重懸、計數並以每孔10k個細胞接種在96孔細胞培養板中。加入C.LIVE Tox Green(1 mM in DMSO)(CYTENA,CY.CL.KIT.002,此染料只能進入失去膜完整性的死細胞,當它與DNA結合時會發出綠色熒光,從而提供有價值的細胞死亡實時讀數)以在孔中獲得250nM的最終濃度。將Ionomycin (Cayman)溶於DMSO中以獲得1mg/mL的儲備濃度。Jurkat細胞在有或無10ng/mL PMA和750ng/mL Ionomycin (1X)或其稀釋液(0.5X,0.25X,0.125X,0.0625X)的組合下生長。使用CELLCYTE X 10X標準掃描模塊每3小時監測一次Jurkat細胞的生長和健康狀況,持續96小時,並對融合與綠色熒光計數進行量化(圖3)。
5. 細胞免疫療法研究
此細胞免疫療法研究與弗賴堡大學CIBSS與BIOSS研究中心的Susana Minguet博士研究小組合作進行。將Nalm-6細胞重懸、計數並以每孔20k個細胞接種在96孔細胞培養板中。將CYTENA的C.LIVE Caspase-3 Green NucView(5 mM,溶解在DMSO中)添加到細胞中,在孔中獲得2.5µM的最終濃度。CAR-T細胞的產生如下文所述。將CAR-T細胞以1:1或3:1的效靶比添加到Nalm-6細胞中,並使用10X標準掃描模塊的CELLCYTE X每小時監測共培養,持續12小時。使用CELLCYTE Studio中的目標對象計數模塊對C.LIVE Caspase-3的總強度進行量化。
實驗結果
1. 免疫細胞生長和增殖
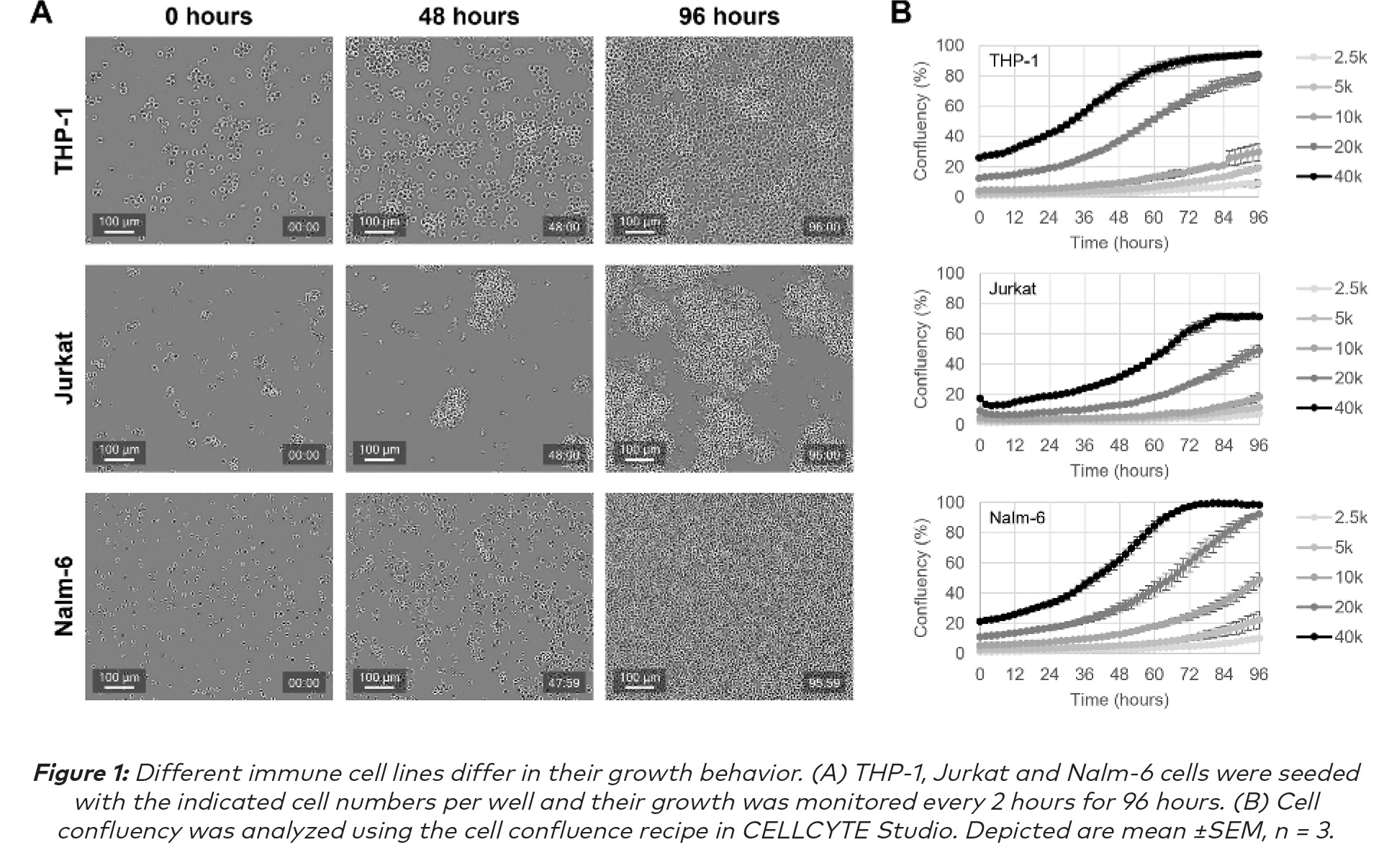
來自CELLCYTE X的增強輪廓圖像顯示:THP-1細胞體積比其他免疫細胞系相對較大,並且在細胞懸液中它們往往以單細胞的形式生長。Jurkat細胞相對較小,主要以懸浮細胞簇的形式生長。Nalm-6細胞的細胞大小與Jurkat細胞大致相同,但在懸浮液中以單細胞形式生長(圖1A)。這些觀察結果已在文獻中得到證實(1)。隨著時間的推移,三種細胞系的生長被量化並顯示出穩定增殖(圖1B)。和預期的一樣,播種密度更高的孔更快達到完全匯合。此外,還註意到Jurkat細胞在觀察到的時間範圍內沒有達到完全融合,這是因為它們是作為細胞簇生長。總之,CELLCYTE X及其可靠的自動聚焦可以對懸浮液中不同生長形態的免疫細胞連續成像,實時分析細胞增殖,提供細胞生長的全面數據。
2. 單核細胞向巨噬細胞的分化
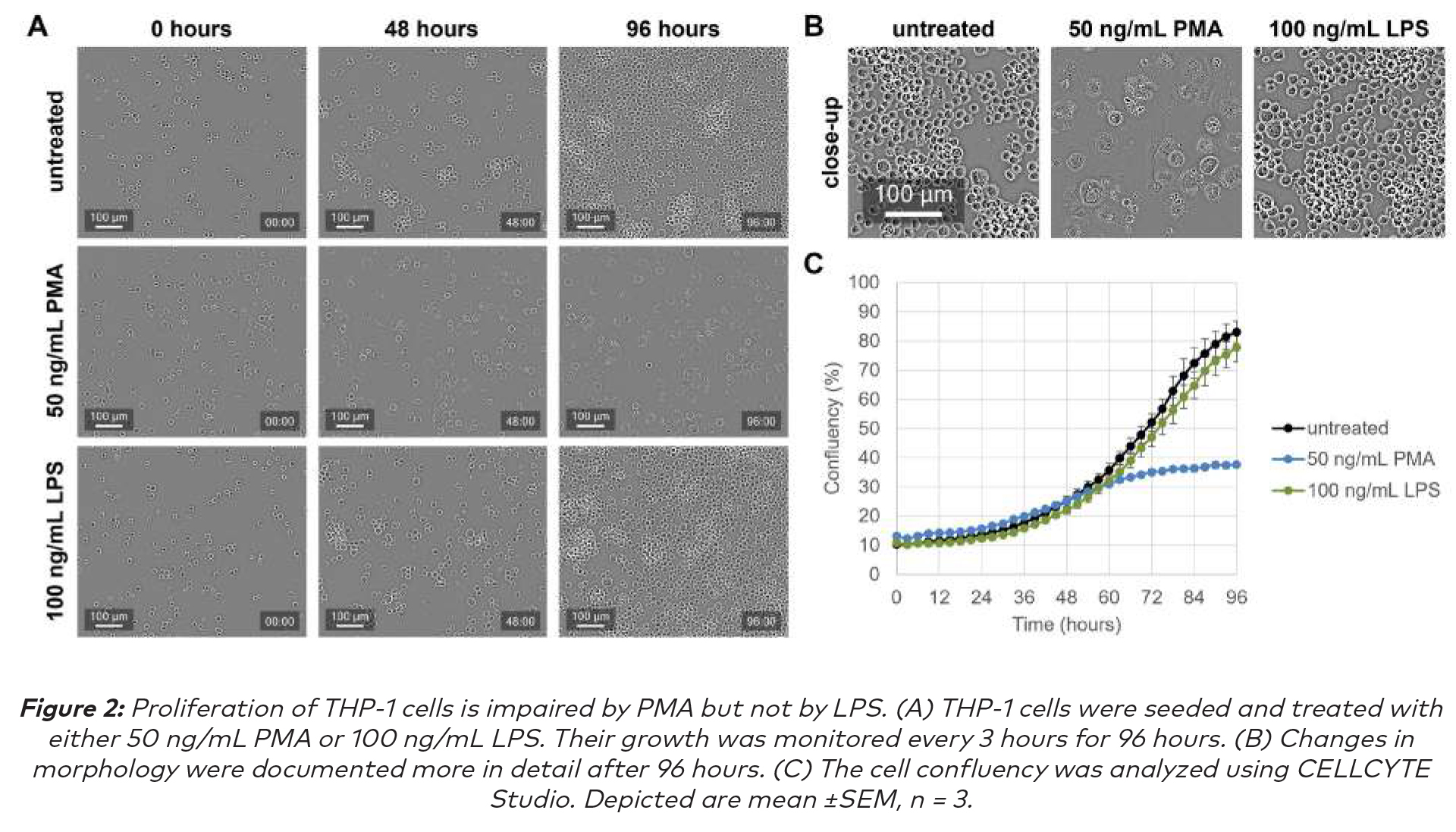
來自CELLCYTE Studio中的細胞融合模塊分析顯示:隨著時間的推移PMA處理的THP-1細胞改變了它們的形態,細胞質體積顯著增加導致了細胞體積增大,並且細胞也開始粘附在細胞培養板上(圖2A和B),在此觀察到的變化與巨噬細胞分化與核質比率降低和細胞粘附增加相關的研究一致(2,3)。此外,與未經處理的對照細胞相比,隨著時間的推移細胞融合減少,表明細胞增殖減少(圖2C)。
CELLCYTE X允許對分化過程進行全面的理解,因為在量化融合的同時提供視覺洞察力。它通過劇烈的形態學變化來跟蹤整個過程,從而準確測量免疫細胞對不同刺激的反應。LPS刺激THP-1細胞不會導致形態變化(圖2A和B),也不會影響細胞增殖(圖2C)。這一觀察結果得到了文獻的證實(4,5)。
3. 激活誘導的細胞死亡
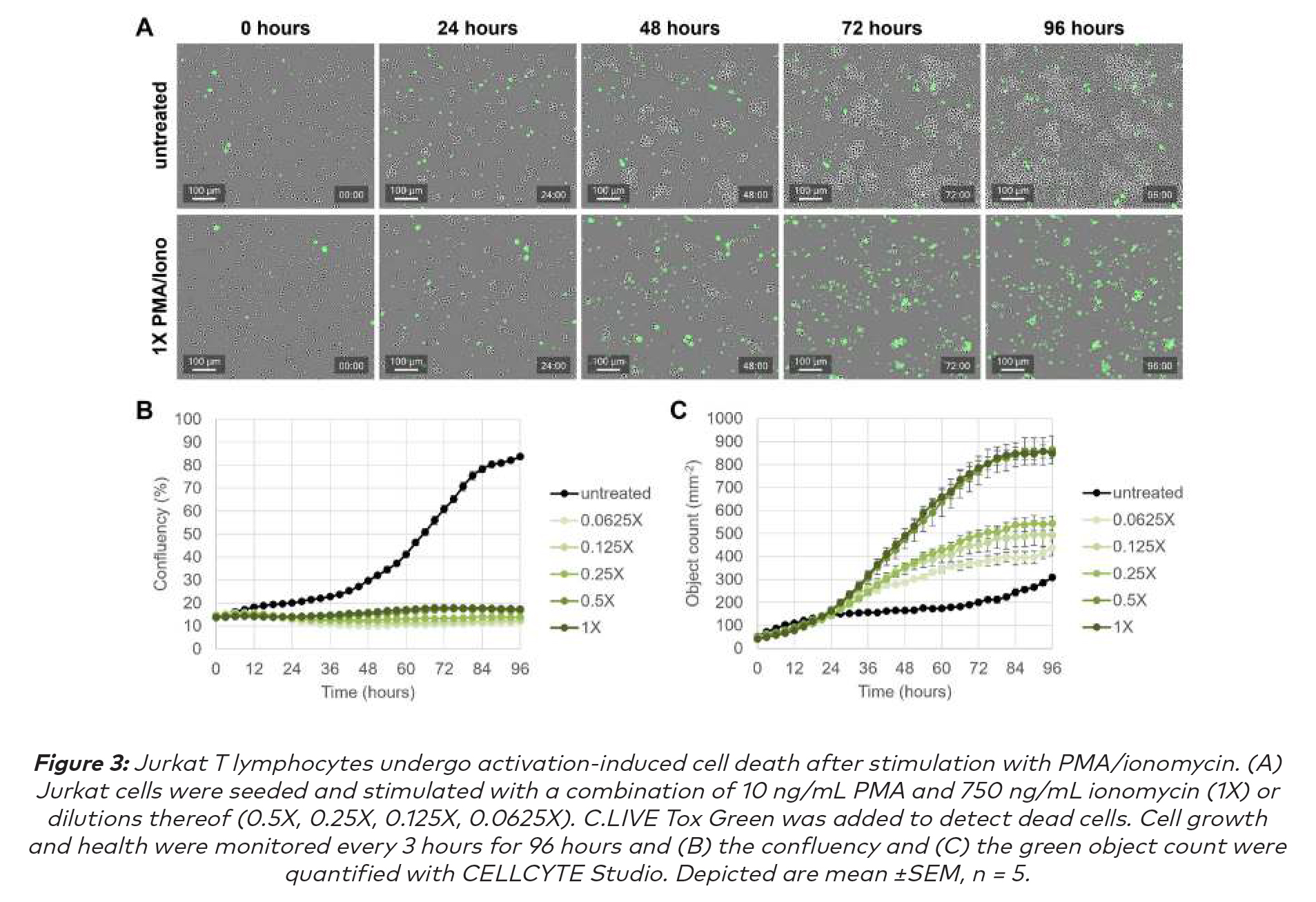
CELLCYTE X 成像顯示:在96小時的過程中,用PMA和離子黴素的組合刺激顯著減少了細胞增殖,未經處理的對照細胞隨著時間的推移顯示出預期的匯合(圖3A和B)。此外,PMA/離子黴素處理的細胞顯示出死亡細胞的增加,這種效應可以以劑量依賴的方式觀察到。對照細胞僅顯示出少量的細胞死亡,尤其是在細胞高度融合的後期(圖3C)。這些觀察結果表明,用PMA和離子黴素治療確實會引發活性誘導的細胞死亡(AICD),正如之前的其他研究所表明的那樣,這些研究認為PMA可以激活蛋白激酶C,而鈣離子載體離子黴素可以提高細胞內Ca2+水平,從而導致數種模擬TCR激活的細胞內信號通路的激活,並導致AICD。(6)
在此項研究中,CELLCYTE X促進了動態量化,可以實時檢測治療效果。CYTENA的C.LIVE Tox試劑允許在AICD過程中直接檢測死細胞。除了自動圖像分析之外,用戶還可以通過基於圖像的方法監測細胞形態,以獲得細胞死亡過程的詳細見解。
4. 激活誘導的細胞死亡
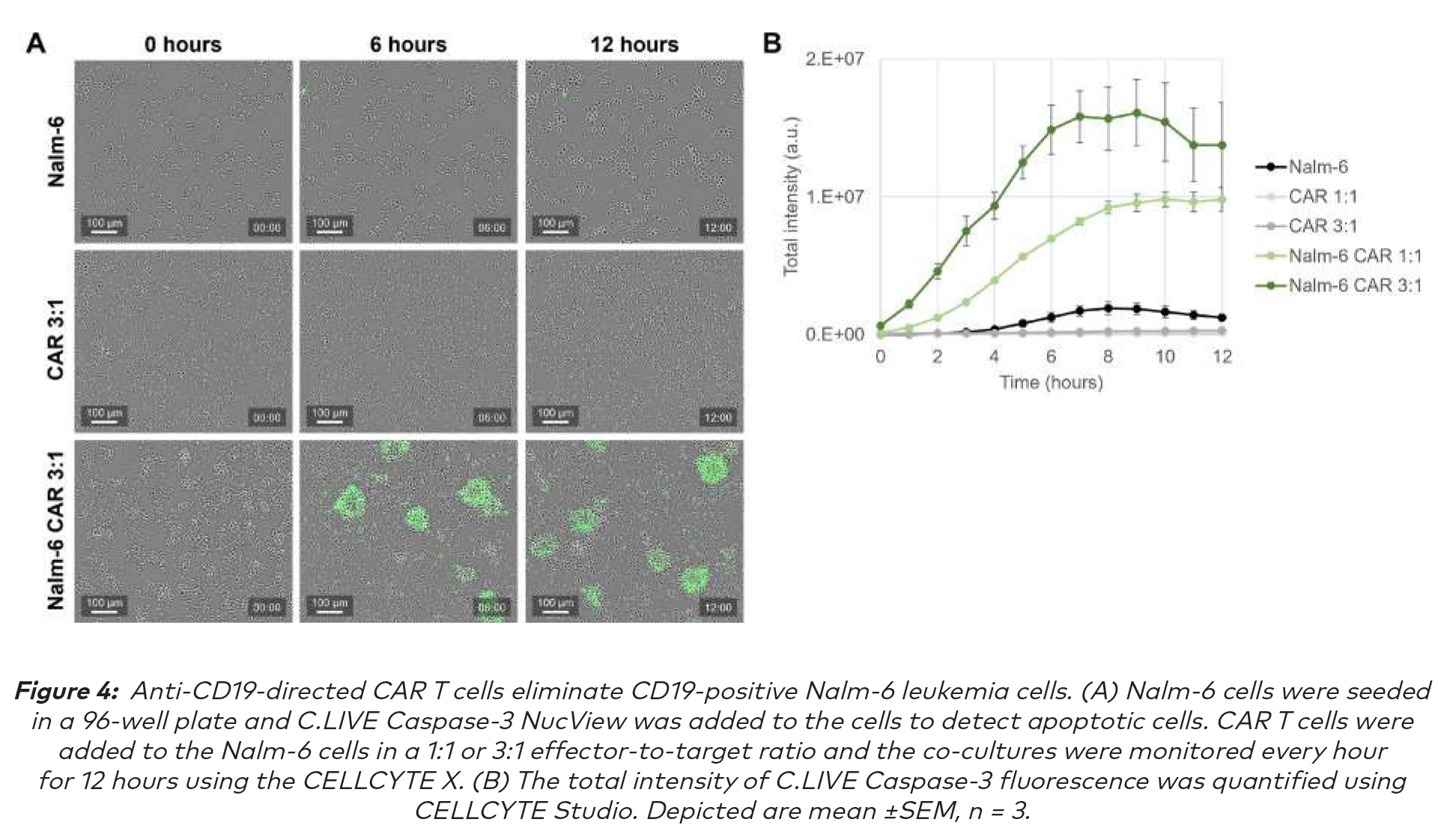
綠色C.LIVE Caspase-3染料總熒光強度顯示,單獨培養的Nalm-6靶細胞和CAR-T效應細胞以單細胞形式生長,且只有少量細胞發生雕亡。相反,Nalm-6細胞和CAR-T細胞的共培養產生細胞簇,並在12小時的時間過程中顯示出綠色總熒光強度的顯著增加,這表明CAR-T細胞可以識別並殺死Nalm-6細胞。
使用CELLCYTE X能夠對殺傷過程進行詳細的動態監測。觀察到的殺傷效果取決於效應細胞與靶細胞的比例,這是由於更高數量CAR-T細胞顯示出更高的總熒光強度,這表明靶細胞的殺傷更有效、更早。此外,每小時掃描可以全面實時記錄這些快速免疫細胞殺傷過程。用CELLCYTE X進行的觀察結果與將CD19導向的CAR - T細胞治療B細胞惡性腫瘤非常有效的研究相一致。(7)
活細胞成像技術在免疫學應用中的優勢
德國Cytena開發的CELLCYTE X 新一代活細胞實時動態成像及功能分析系統可內置在任何品牌型號的CO2培養箱中,對正常培養中的細胞做長時間實時24小時循環拍攝成像,監測細胞的生長變化狀態,並對其進行功能分析,輸出隨時間變化曲線、各個時間點圖片、過程影像等數據結果。在免疫學應用中,它有以下優勢:
自帶強大的自動聚焦算法能夠連續跟蹤不同生長形態的懸浮液中生長的各種免疫細胞。
使用自動活細胞成像平臺捕捉免疫反應的快速動力學。
CELLCYTE X的分析軟件提供多功能和高度特異性的讀數,記錄免疫細胞生長和健康、巨噬細胞分化和T細胞殺傷分析中的反應。
通過定性形態學研究和定量測量,對不同刺激的免疫反應進行綜合評估。
參考文獻
1. Components of the Immune System. Primer to the Immune Response. Elsevier; 2014: 21-54. DOI:10.1016/B978-0-12-385245-8.00002-9
2. Daigneault M, Preston JA, Marriott HM, et al. The identification of markers of macrophage differentiation in PMA-stimulated THP-1 cells and monocyte-derived macrophages. PLoS ONE. 2010; 5(1): e8668. DOI:10.1371/journal.pone.0008668
3. 1Pinto SM, Kim H, Subbannayya Y, et al. Comparative proteomic analysis reveals varying impact on immune responses in phorbol 12-myristate-13-acetate-mediated THP-1 monocyte-to-macrophage differentiation. Frontiers in Immunology. 2021; 12. DOI:10.3389/fimmu.2021.679458
4. Widdrington JD, Gomez-Duran A, Pyle A, et al. Exposure of monocytic cells to lipopolysaccharide induces coordinated endotoxin tolerance, mitochondrial biogenesis, mitophagy, and antioxidant defenses. Frontiers in Immunology. 2018; 9. DOI:10.3389/fimmu.2018.02217
5. Tucureanu MM, Rebleanu D, Constantinescu CA, et al. Lipopolysaccharide-induced inflammation in monocytes/macrophages is blocked by liposomal delivery of Gi-protein inhibitor. International Journal of Nanomedicine. 2018; 13: 63-76. DOI:10.2147/IJN.S150918
6. Ai W, Li H, Song N, Li L, Chen H. Optimal method to stimulate cytokine production and its use in immunotoxicity assessment. International Journal of Environmental Research and Public Health. 2013; 10(9): 3834-3842. DOI:10.3390/ijerph10093834
7. Abramson JS. Anti-CD19 CAR T-cell therapy for B-cell non-hodgkin lymphoma. Transfusion Medicine Reviews. 2020; 34(1): 29-33. doi:10.1016/j.tmrv.2019.08.003



