2023.03.27
賓夕法尼亞大學佩雷爾曼醫學院的研究人員在研究結締組織內因肌腱炎而惡化的細胞時發現,當細胞所處的微環境發生病變時,會導致染色質產生空間和密度的不可逆變化,使其無法正常編碼遺傳信息。這項研究結果於2022年8月22日發表在Nature Biomedical Engineering上,指出了新療法(例如小分子療法)的可能性。

染色質空間組織變化大多發生在納米尺度上(10-100nm),使用傳統的熒光顯微鏡來研究這一現象一直具有挑戰性。雖然基於高通量染色體構象捕獲的方法能夠提供關於基因組組織有價值的信息,但這種方法通常需要大量的細胞,掩蓋了細胞間的異質性。
在此研究中,作者使用Nanoimager單分子成像與功能分析系統,獲得了染色質結構的納米級高分辨率圖像,確定了結締組織的微觀化學物理環境在納米尺度上如何調節染色質的組織變化,為治療結締組織疾病提供了新的治療策略。
研 究 結 果
1. 組織惡化改變hTCs的染色質組織
已知組織惡化或衰老會改變致密結締組織的力學環境,因此作者使用超分辨率成像和定量分析來確定衰老和組織惡化是否會導致基因組組織的改變。
從三種不同供體(1.健康的年輕人、2.已確診肌腱病的年輕人、3.健康的老年人)的人體肌腱中分離出肌腱細胞(hTCs),超分辨率圖像顯示,健康年輕人的hTCs細胞核中,染色質分布在整個細胞核中。然而,組蛋白H2B 出人意料地主要定位於已確診肌腱病的年輕人hTCs細胞核的核外周。為進一步量化不同細胞類型中的染色質組織,使用圖像分割軟件Voronoi進行細分,結果顯示,與健康hTCs相比,無論核外圍還是核內部的染色質,病變hTCs的稀疏和致密染色質間室都更加緊湊。這些數據表明,組織惡化和衰老都影響hTCs中染色質組織的空間不同模式。
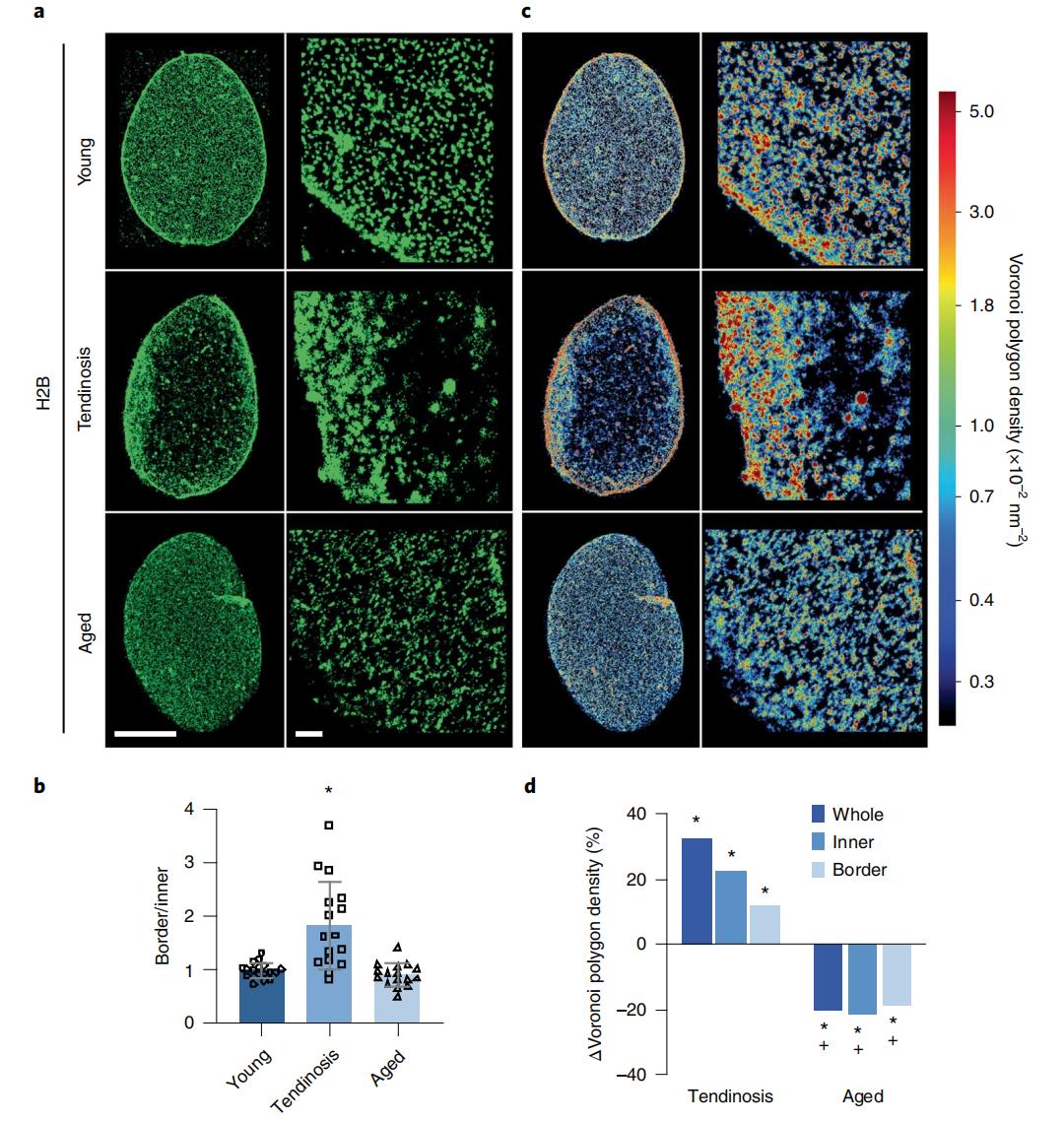
圖1.(a)5um和300nm標尺下的H2B 的STORM圖像。(b)單位面積內組蛋白H2B在核邊界和核內部區域內的定位數量比例。(c)是(a)中的組蛋白H2B經Voronoi渲染後的數據,紅色是小的Voronoi多邊形,具有較高的組蛋白 H2B密度;藍色是大的Voronoi多邊形,具有較低的組蛋白 H2B密度。(d)年輕、肌腱病和老年供體hTCs致密染色質室中染色質凝縮的變化。
2. 基質剛度改變hMSCs中的染色質組織
組織(包括肌腱組織)具有很大的剛度範圍,組織變性能改變細胞外基質(ECM)的化學物理環境。因此,作者假設,病變hTCs(或其祖細胞)基因組組織的變化可能是由惡化的組織微環境中的異常化學-力學信號驅動的,特別是由組織剛度的變化引起的。
為了評估生理和病理相關的生物物理信號如何在納米尺度上影響基因組組織,作者選擇了人間充質幹細胞(hMSCs)這種可以根據基質剛度來適應表型的細胞,用這些在不同基質上培養的模型細胞來優化染色質的定量超分辨率成像,並記錄不同的基因組組織的變化。數據表明,基質剛度在納米尺度上調控了hMSCs的染色質在空間上的組織和凝縮。
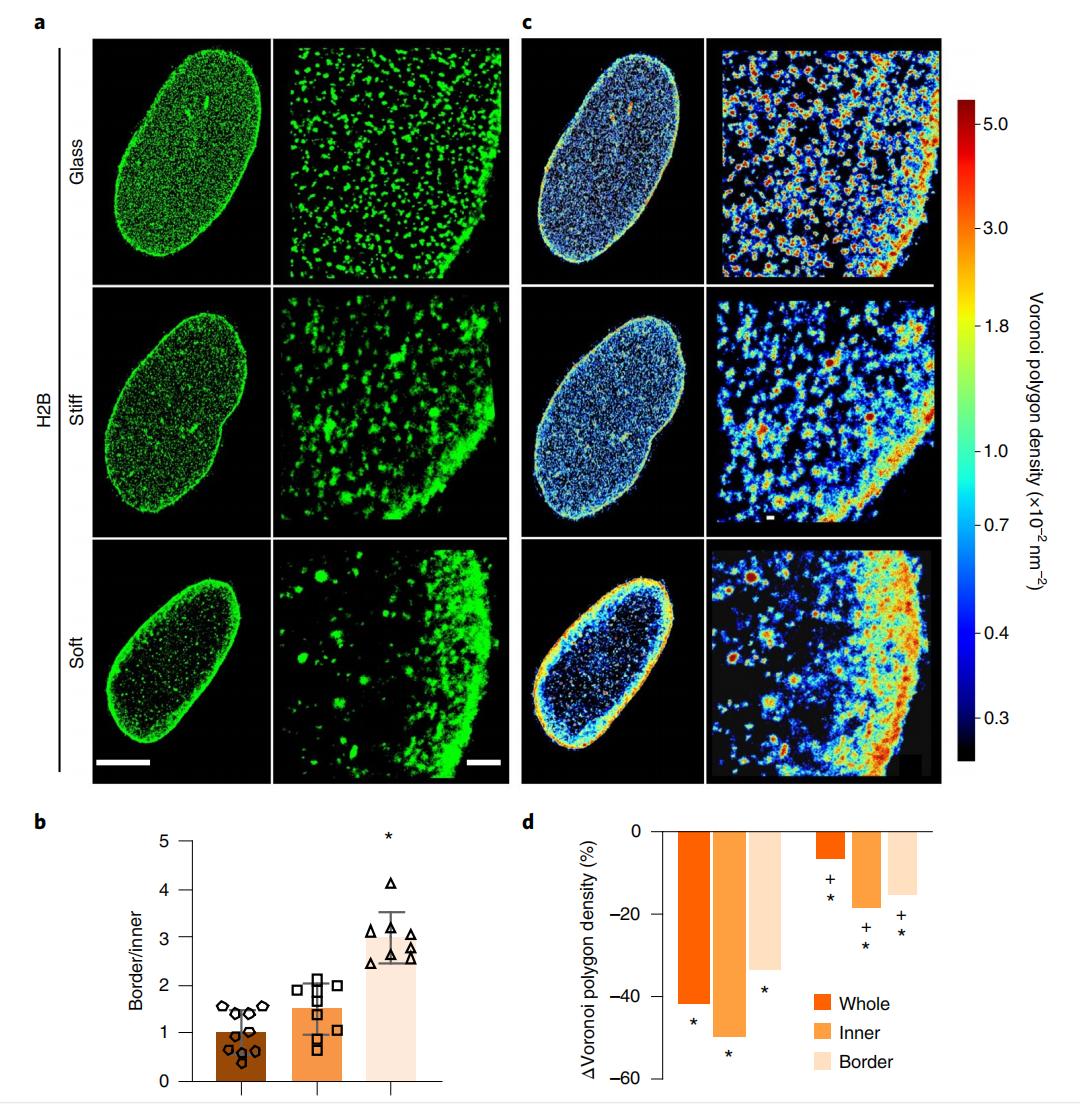
圖2.(a)培養在三種不同基質上的hMSCs內組蛋白H2B的STORM圖像。在Stiff和Glass兩組裏,H2B在核內分布更為均一,而在Soft組裏,H2B則更多分布於核外圍。(b)單位面積內組蛋白H2B在核邊界和核內部區域內的定位數量比例。(c)是(a)中的組蛋白H2B經Voronoi渲染後的數據,紅色是小的Voronoi多邊形,具有較高的組蛋白 H2B密度;藍色是大的Voronoi多邊形,具有較低的組蛋白 H2B密度。(d)三種不同基質上hMSCs細胞核致密染色質室染色質凝縮的變化
3. 基質剛度改變hMSCs的組蛋白甲基化水平
接著,作者研究了基質剛度是否也會導致活性染色質(標記物為H3K4me3)和異染色質(標記物為H3K27me3)的定位和凝縮狀態的變化。
作者用兩種特定組蛋白修飾的抗體對hMSCs進行標記,並獲得了三種基質條件下的超分辨率圖像。H3K4me3的熱圖和定量分析表明,與玻璃基質培養的hMSCs相比,在硬基質培養的hMSCs中H3K4me3的水平略有升高,而在軟基質培養的hMSCs中,H3K4me3的水平顯著降低。這些數據與前面描述的H2B凝縮分析一致,表明活性組蛋白標記的丟失與軟基質上染色質凝縮的增加相關。相反,與玻璃基質相比,H3K27me3在硬基質上的含量較低(特別是在核內部),而在軟基質上的含量較高(特別是在核外圍)。這些結果表明,外周染色質定位的增加和軟基質上染色質凝縮的增加與H3K27me3水平的增加進一步相關,這表明軟基質可能導致基因抑製。
在觀察到基質剛度在納米尺度上調控染色質的組織,以及基質依賴性染色質重構與組蛋白甲基化標記水平的變化相關後,作者進一步研究了zeste同源物2 (EZH2,催化H3K27me3)的甲基轉移酶增強子的作用,數據表明基質剛度通過改變hMSCs中的細胞收縮力和組蛋白甲基化狀態來調節染色質的空間組織和凝縮。
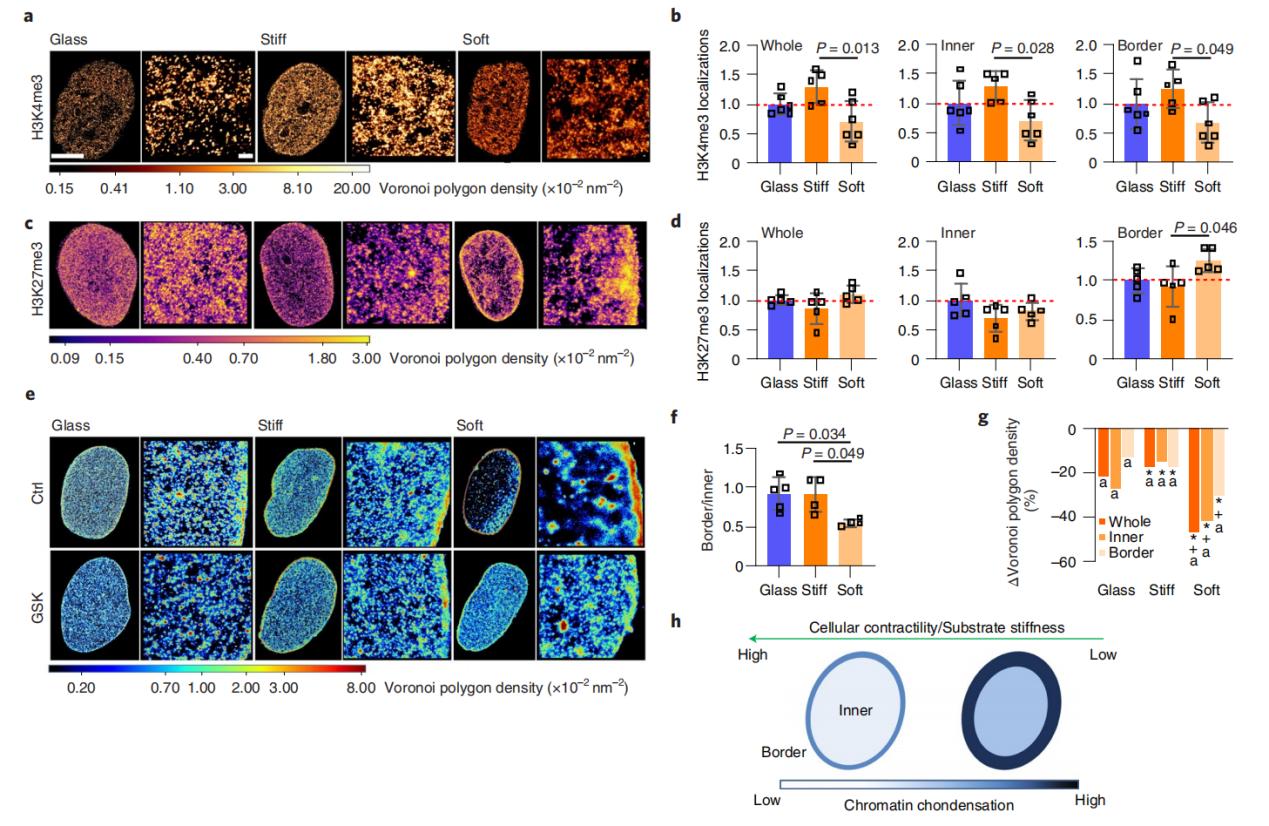
圖3.(a)和(c)分別是H3K4me3和H3K27me3的STORM圖像。(b)和(d)是在不同的基質上培養的hMSCs中,在單位面積內在核邊界和核內部區域內H3K4me3和H3K27me3的定位數量比例。(e)是三種不同基質上培養的經GSK和不經GSK處理的hMSCs細胞核中組蛋白H2B數據,經Voronoi渲染後,紅色是小的Voronoi多邊形,具有較高的組蛋白 H2B密度;藍色是大的Voronoi多邊形,具有較低的組蛋白 H2B密度。(f)使用和不使用GSK處理時,核邊界和核內區域之間H2B定位的變化被量化為核邊界單位面積上H2B定位的數量與核內區域單位面積上H2B定位的總數之比。(g)與對照組hMSCs相比,GSK處理的hMSCs中致密染色質凝縮水平的變化。
4. 染色質重構的預測
異染色質的形成以前被認為是多種機製的結果,包括染色質和染色質相關蛋白(如HP1α)的液-液相分離、連接蛋白組蛋白H1中和靜電電荷和轉錄沈默。如前所述,已知特定的表觀遺傳標記與濃縮異染色質或開放性常染色質相關。然而,表觀遺傳調控因子對染色質組織的影響尚未完全了解,乙酰化和甲基化的動力學是否能改變染色質的凝縮尚不清楚。為了探索這些,並確定觀察到的基質剛度對染色質凝縮的影響是否是組蛋白甲基化狀態變化的結果,作者開發了一個模擬異染色質形成的相場模型。這個模型概括了組蛋白甲基化水平的基質依賴性變化如何影響細胞核染色質的空間組織的實驗結果,為乙酰化和甲基化水平與相分離競爭並影響染色質組織提供了數據支持。
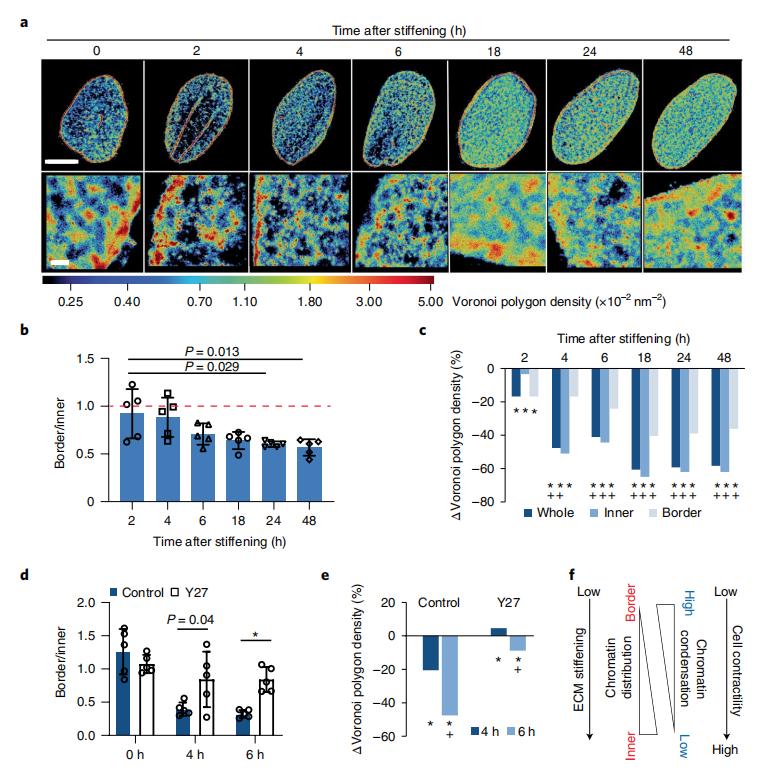
圖4.(a)甲基化的增加對染色質組織的影響,藍色和紅色分別代表常染色質和異染色質富集的區域。(b)異染色質簇的大小與甲基化水平的比例關系。(c)核邊界異染色質結構域(BHDs)厚度與甲基化水平的比例關系。(d)在軟或硬基質上培養的細胞,實驗測量和模型預測的核邊界和核內部異染色質百分比。左邊圖像對應的是前圖中按照Voronoi多邊形大小編碼的H2B顏色的STORM圖像。右邊的圖像與模型預測相對應,藍色為常染色質,紅色為異染色質。(e)在軟基質上培養的經GSK343處理或不經GSK343處理的細胞,實驗測量和模型預測的核邊界和核內部異染色質百分比。左邊圖像對應的是前圖中按照Voronoi多邊形大小編碼的H2B顏色的實驗STORM圖像。右邊的圖像與模型預測相對應,藍色為常染色質,紅色為異染色質。
5. 染色質在動態力學信號下快速重組
現有數據表明,基質剛度通過影響細胞相容性和下遊甲基轉移酶活性來改變染色質的組織和定位,但這種靜態時不變的力學信號不能復製主動負載細胞環境中重構的動態和時變特征。因此,作者接下來研究了生物物理環境的動態變化如何影響hMSC的細胞核在納米尺度上的染色質組織。作者使用原位基質增強系統來評估人骨髓間充質幹細胞中H2B納米空間組織和染色質凝縮的變化。細胞在「硬化水凝膠」系統上培養,該系統提供了基質剛度從軟(約3kPa)到硬(約30kPa)的力學狀態的快速變化。H2B密度的熱圖顯示,硬化後的最初6小時,染色質主要定位於核周邊,硬化後6~48h,染色質從核周邊向核內部不斷重新分布。染色質空間組織的這些變化伴隨著稀疏和致密染色質室的凝縮狀態的持續下降。
有趣的是,硬化後2h開始凝縮變化,因此在空間組織變化之前,這表明染色質的解聚可能導致其在細胞核中的空間重構。硬化後18小時,解凝縮量達到起始值的60%左右,並持續至第7天。作者接下來研究了肌動球蛋白驅動的收縮力在染色質組織和響應基質硬化的縮合中的作用。數據表明,ECM-硬化介導的染色質解致密化和從hMSC細胞核邊界到內部的再分布需要肌動球蛋白為基礎的細胞收縮。總之,這些數據表明,動態生物物理擾動以復雜而快速的方式調節hMSCs細胞核中的納米尺度的染色質組織。

圖5.(a)硬化後0-48h,組蛋白H2B從核外圍到核內部連續重分布的STORM圖像。(b)核邊界H2B定位總數與核內區域H2B定位總數的比值。(c)硬化後0-48h,hMSCs內致密染色質室中染色質凝縮的變化。(d)在加/不加Y27處理硬化後不同時間的水凝膠上培養的hMSCs,單位面積核邊界H2B定位總數與核內部H2B定位總數之比,表明Y27在硬化後阻止了染色質從核邊界到核內部的重新定位。(e)在加/不加Y27的硬化水凝膠上培養的hMSCs中致密染色質室染色質凝縮的變化,Y27處理可防止硬化後致密染色質凝縮隨時間的減少。(f)示意圖顯示ECM硬化如何通過肌動球蛋白為基礎的細胞收縮來調節hMSCs中的染色質分布和凝縮。ECM硬化使染色質從邊界重新分布到hMSC核的內部區域,導致染色質去凝,這需要細胞的收縮。
6. 「惡化」信號改變hTCs的染色質組織
鑒於生物物理信號對體外納米尺度上染色質組織的影響的結果,作者接下來提出了初步假設:化學物理環境(例如軟ECM、缺氧和炎癥)的惡化信號可能引起納米尺度上染色質重構,並導致年輕健康的hTCs呈現與老年或惡化的(肌腱病)hTCs相似的特征。為了驗證這一假設,作者首先在玻璃、硬(30kPa)或軟(3kPa)基質上在基礎生長培養基中培養從年輕健康供體分離的hTCs 2天。超分辨圖像再次顯示了H2B定位,在玻璃基質上培養的年輕健康hTCs的細胞核中形成明顯的H2B納米結構域。有趣的是,年輕hTCs在硬基質上培養時,整個細胞核中稀疏和濃縮的染色質室的染色質凝縮減少,達到與在玻璃基質上培養的老年hTCs相似的水平。而在軟基底上培養時,染色質重新定位到核周邊並變得更加致密,特別是在核內部,這與惡化的hTCs相似。總的來說,這些數據表明,肌腱老化或微損傷引起的組織力學性質改變可能會導致疾病中染色質組織的一些異常變化。
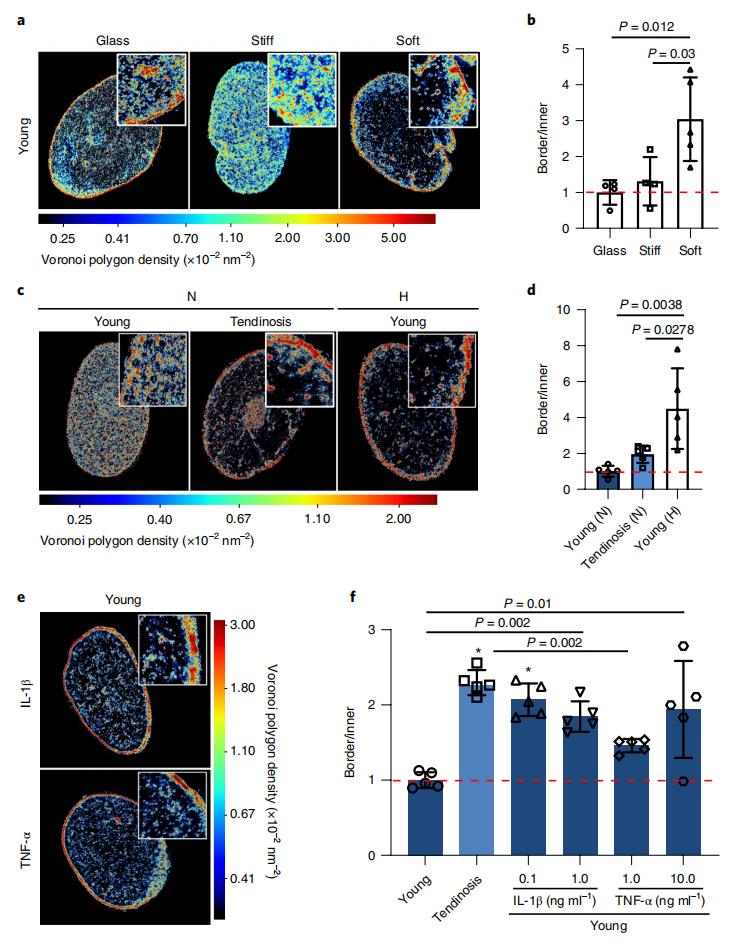
圖6.(a)培養在三種不同基質上的hTCs內組蛋白H2B的STORM圖像。(b)核邊界單位面積上H2B定位總數與核內區域H2B定位總數的比例,顯示在軟基質上培養的hTCs中H2B重新定位到核邊界。(c)組蛋白H2B的STORM圖像,展示在常氧條件下年輕的和肌腱病的hTCs中H2B的定位變化,以及在低氧條件下年輕的hTCs中的H2B定位變化。(d)核邊界單位面積上H2B定位總數與核內區域H2B定位總數的比值,顯示缺氧條件下年輕hTCs中H2B重新定位到核邊界。(e)組蛋白H2B的STORM圖像,展示的是在有/沒有IL-1β和TNF-α的玻璃基質上培養的hTCs中H2B定位的變化。(f)核邊界單位面積上H2B定位總數與核內區域H2B定位總數的比例,顯示hTCs在經炎癥因子處理後H2B的重新定位到核邊界。
7. 惡化影響hTCs的力學靈敏度
鑒於hTCs能夠通過改變染色質的空間組織和凝縮來迅速應對力學環境的變化,作者最後研究了組織惡化或老化如何影響其力學敏感性。超分辨成像結果顯示,年輕、肌腱病和老年hTCs中的H2B在硬化後4小時內主要定位於核周邊。硬化24小時後,年輕hTCs中的染色質在整個細胞核中變得更均勻地分散和去致密。老化細胞對基質剛度的增加也有相同的反應趨勢,但在染色質解致密化方面程度較低。然而,當肌腱病變細胞在硬化的水凝膠上培養時,染色質的空間組織沒有變化,特別是在核周邊染色質失活的程度,與年輕和老年細胞相比明顯更低。這些數據表明,hTCs染色質組織的長期改變可能與惡化引起的力學靈敏性喪失有關。
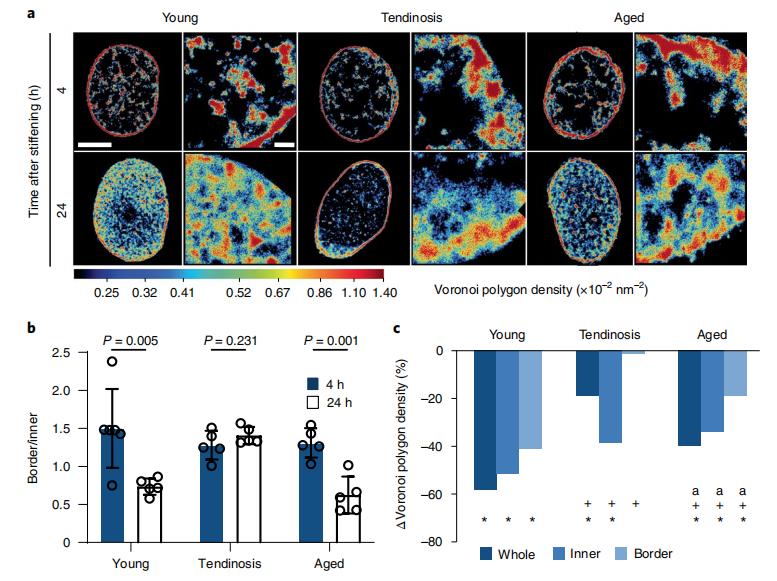
圖7. (a)硬化後4h和24h,不同組的hTCs組蛋白H2B分布的STORM圖像。(b)核邊界單位面積上H2B定位總數與核內區域H2B定位總數的比例,顯示在肌腱病組的hTCs在基質硬化後H2B重新定位到核內部的過程沒有及時反應。(c)硬化24 h後致密染色質室中染色質凝縮的變化。
研 究 結 論
在這項研究中,基於強大的超分辨率顯微鏡Nanoimager,作者在納米尺度上展示了健康纖維組織和祖細胞細胞核中染色質組織對力學性能具有高度的響應性,這種響應性依賴於獨特的細胞骨架網絡和組蛋白修飾的動態變化,這對如何以及何時應用臨床療法治療人類疾病具有重要的指導意義。
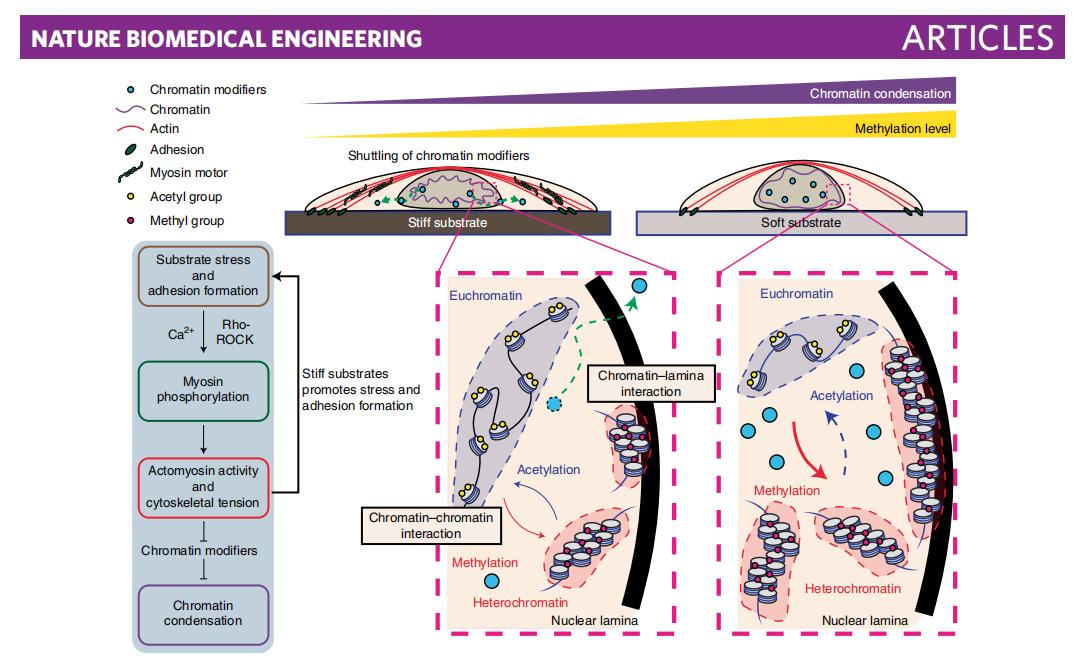
圖8.基質的高硬度改變了以肌動球蛋白為基礎的細胞收縮性,從而促進肌動蛋白應力纖維的形成和局部粘附,並調節染色質修飾物(例如HDAC和EZH2)進出細胞核。這些表觀遺傳修飾物通過調節組蛋白乙酰化/甲基化水平改變染色質在納米尺度上的空間組織和凝縮。
Nanoimager
Nanoimager作為新一代單分子成像系統的標誌性代表,相比傳統的熒光顯微鏡,在技術的先進性方面具有巨大突破。它克服了光衍射的限製,橫向分辨率可達20nm、軸向分辨率可達50nm,並支持同時雙色成像和順序四色成像,可在空間上對形態學和亞細胞動態進行精確的納米級研究,進一步揭示分子相互作用細節,使深入探索變得更簡單。
Nanoimager 集成多種高端成像技術於一體,具備dSTORM(隨機光學重建顯微技術)、PALM(光激活定位顯微技術)、Single Particle Tracking(單分子動態追蹤與定量)、smFRET(單分子FRET技術)和Confocal(共聚焦技術)等技術模塊,這些優勢使它成為信號通路轉導、腫瘤和外泌體標誌物、病毒增殖和裝配、細胞亞顯微結構表征等研究領域在單分子水平上進行顯微分析的重要幫手。



