2022.11.16
對人類活動的動態記錄促使了抖音等視頻的大流行,同樣的,對科學的觀察和記錄也有同樣的追求,正在從靜態的「快照」觀察轉向對活體動態過程的描述。以實現發現和監測為目的的活細胞成像正是目前研究動物細胞增殖的理想手段,能幫助生物學家更好地了解實驗條件可能對不同系統中細胞增殖的影響。
本文中,我們將展示使用高通量活細胞成像平臺CELLCYTE X™如何方便地獲得多孔板中細胞的全面、長時間、多參數和實時的狀態,並證實,CELLCYTE X™基於輪廓增強的細胞匯合百分比與熒光信號強度和核或細胞計數指標相結合,可成功用於表征藥物在人和鼠不同細胞類型中的藥理學特征。
CELLCYTE X 在藥理學篩選中的應用
實驗背景
細胞增殖是基礎研究和轉化研究,尤其是免疫腫瘤學應用藥物發現中的關鍵指標。細胞增殖的變化通常通過終點測定來評估,例如通過核苷類似物BrdU和EdU的摻入來定量DNA合成,或通過分析增殖報告蛋白的表達,例如Ki-67和增殖細胞核抗原(PCNA)。但在近來20年,活細胞成像已被證實是評估細胞增殖的一種更加優越的技術,因為它依賴於在培養箱中數天或數周的生長細胞圖像的采集和分析,從而提供受控的、一致的環境條件下細胞群的實時數據。
在此,我們演示了CELLCYTE X™如何使用多個參數實時監測細胞增殖,詳細介紹如何通過使用小鼠胚胎成纖維細胞(MEF)中的無標記融合測量或通過表達熒光團細胞的多參數分析,定量和定性評估不同藥物的藥理學。
實驗結果
1. 細胞增殖的多參數分析
以CELLCYTE X™增強輪廓(EC)的高對比度亮場形式和綠色(綠色FL)、紅色(紅色FL)熒光通道對生長中的視網膜色素上皮-1(RPE-1)細胞成像,分別監測核和細胞質熒光團的表達。然後使用CELLCYTE X軟件同時分析這些圖像,以便以EC匯合百分比、綠色FL細胞計數和紅色FL細胞核計數的形式推斷細胞增殖的定量測量(圖1)。
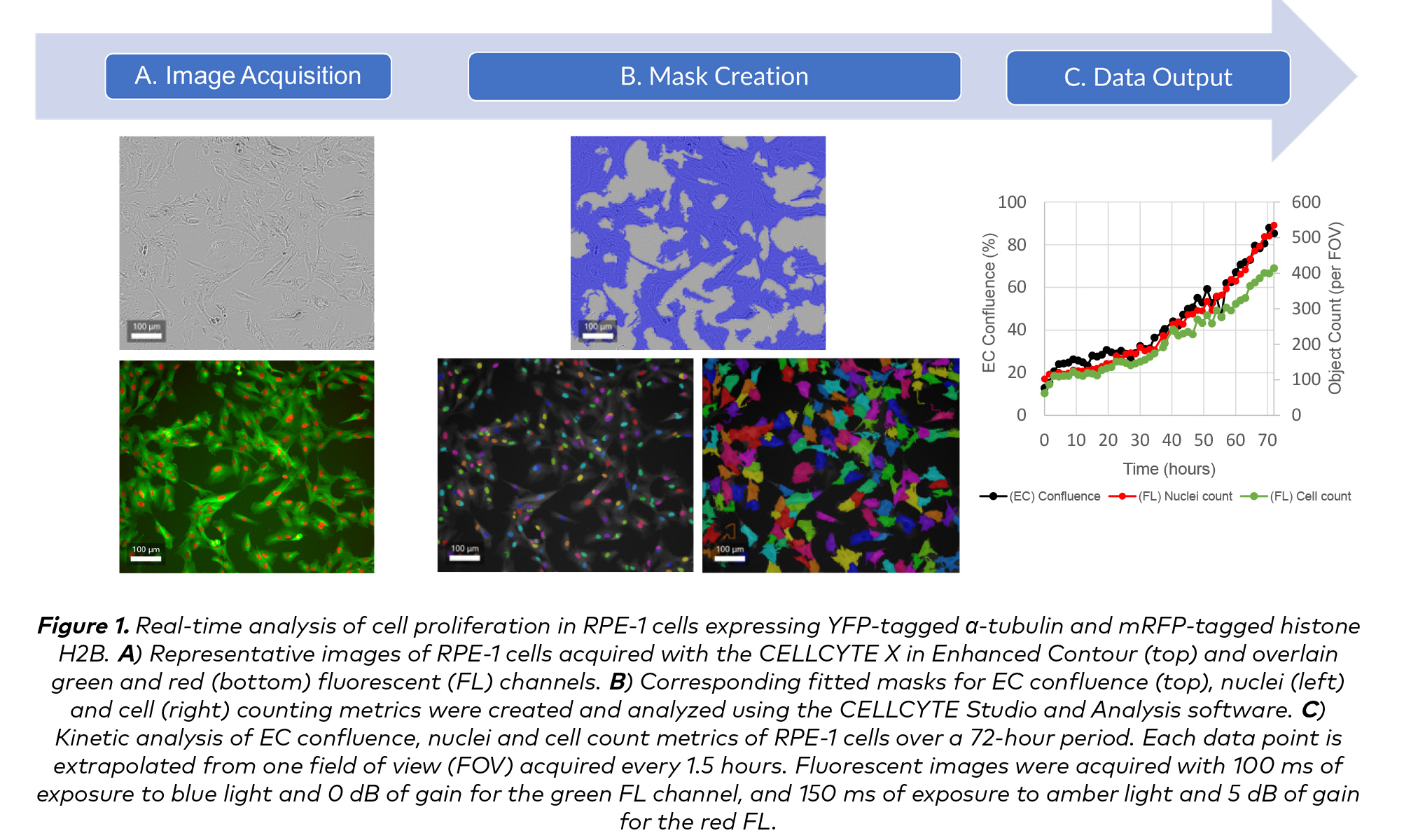
同時測量多個熒光信號的能力使CELLCYTE X™成為實時分析共培養系統的理想平臺(圖2)。
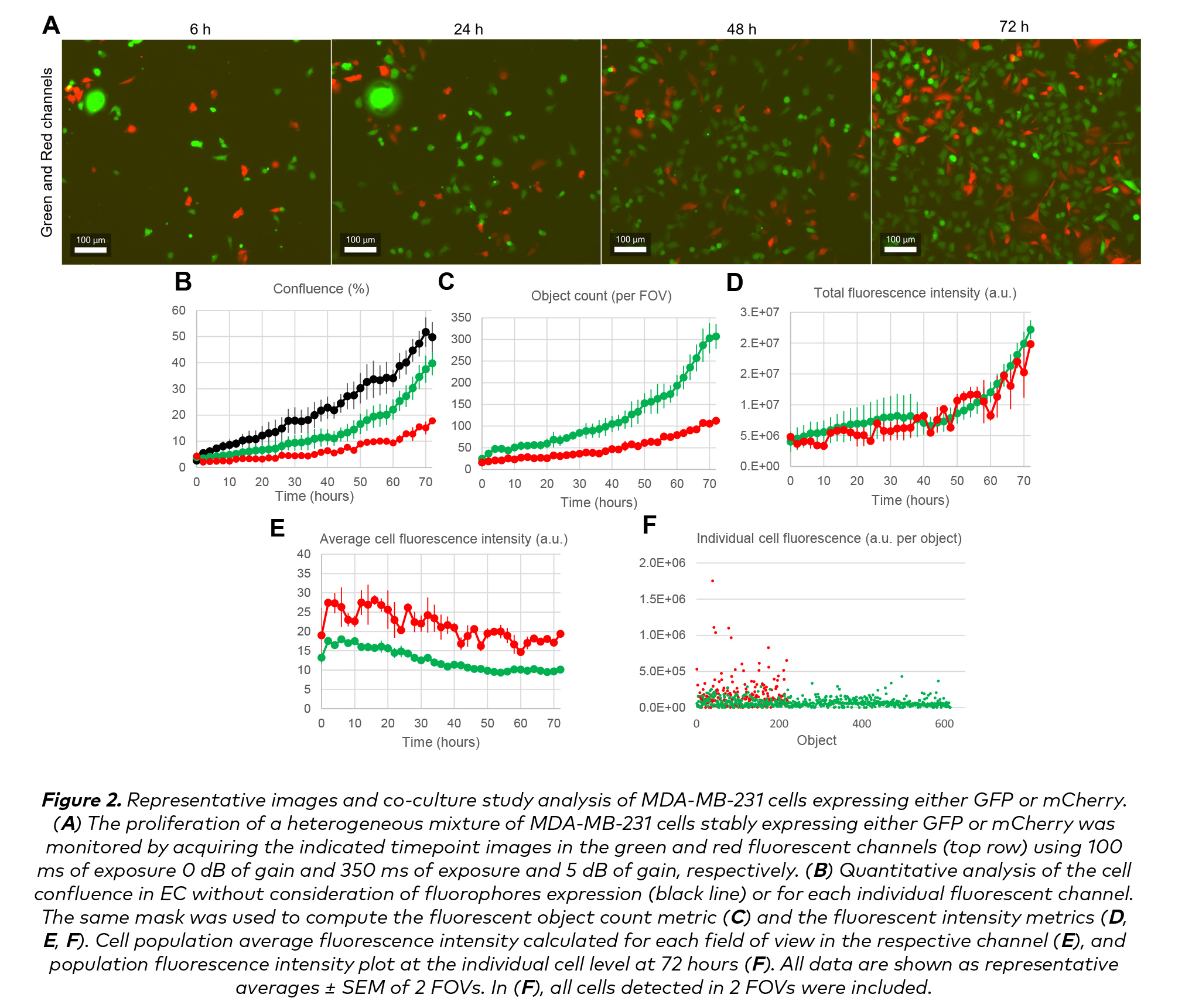
通過使用熒光匯流面積百分比衡量指標,分析表達綠色或紅色熒光團的乳腺癌細胞系的增殖情況(圖2B)。每個視場的熒光物體計數表明GFP表達細胞具有優越的增殖能力(圖2C)。熒光強度(a.u)指標更全面地反映了個體細胞隨時間的增殖行為(圖2D和2E)。實際上,總體紅色熒光強度表明,盡管表達mCherry的細胞增殖較低,但熒光信號強度與GFP信號相當(圖2D)。這可以通過單個熒光指標來解釋,可以從圖2E中所示的隨時間變化的種群平均水平進行分析,也可以從圖2F中所示的所有圖像的單個細胞水平進行分析,證實了表達mcherry的細胞數量較少,但與表達GFP的細胞相比,它們發出的熒光信號卻更強烈。
使用CELLCYTE X Studio Software,用戶還可以調整熒光掩膜靈敏度,只檢測表達一定熒光團水平的細胞,這在培養表現不同表達程度的異質細胞群體時非常有用。通過利用這些指標,可以在高通量設計中解釋可變熒光團表達,如應用在CRISPR/Cas9 gRNA文庫或facs排序細胞的基因篩選中。
2. 抑製細胞增殖藥物的無標記劑量反應分析
劑量反應分析是評估藥物研發過程中各種化合物作用的關鍵工具,特別是在評估藥物對不同類型細胞增殖的影響時。CELLCYTE X™增強輪廓成像方式是一種高對比度亮場顯微鏡,可用於獲得精確的無標記細胞匯流測量。
為了驗證細胞匯合衡量指標對高通量篩選平臺的適用性,我們監測了在96孔板中用Cycloheximide(一種常用的細胞毒性蛋白合成抑製劑)和喜樹堿(一種DNA拓撲異構酶I抑製劑)處理的MEF細胞的增殖情況。
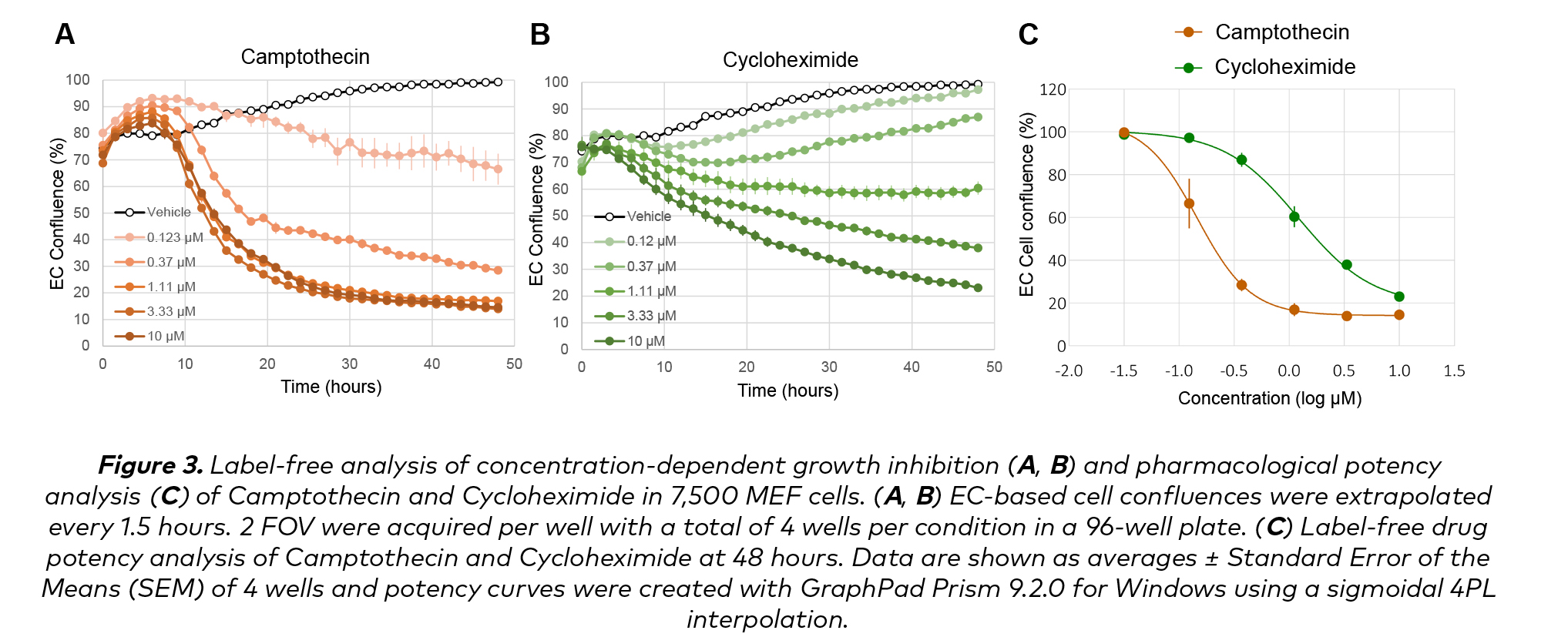
為了評估EC匯流衡量指標的敏感性和粒度的可譯性,我們獲得這兩種藥物的1:3稀釋劑量-反應曲線,覆蓋從0.123 μ M到10 μ M 2-log的濃度範圍。喜樹堿和Cycloheximide治療均獲得了穩健的化合物濃度依賴性劑量反應(圖3)。喜樹堿處理的MEF,特別是在較低劑量時,顯示出在應用該化合物後的前6小時內匯合度增加。隨後,細胞毒性作用很快顯現出來。在濃度為0.123µM時,細胞匯合穩定下降,在濃度為1.11µM至10µM的情況下,匯合呈動力學等效指數下降(圖3A)。另一方面,經Cycloheximide處理的細胞表現出更大範圍的細胞毒性動力學。雖然在前3小時內也觀察到匯合度略有增加,但隨後是一個較慢且較穩定的下降,在濃度峰值時看到的動力學更快(圖3B)。
這些化合物的不同效力反映在它們的IC50中,該濃度是用48小時的細胞匯合數據計算的。MEF細胞顯然對喜樹堿(IC50=0.15µM,CI95 0.12–0.17µM)比Cycloheximide(IC50=1.15µM,CI95 1.03–1.48)更敏感(圖3C)。
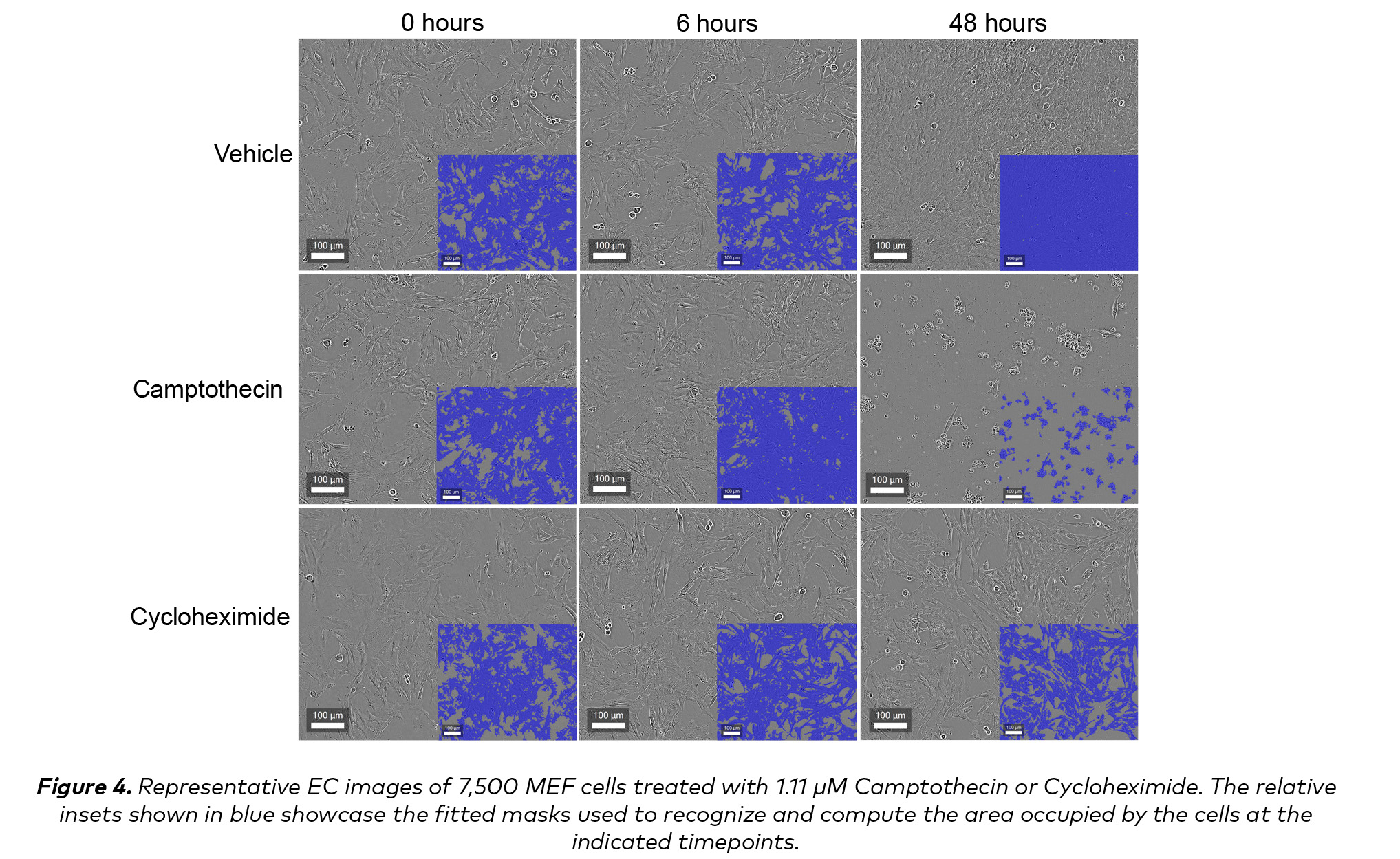
這一定量數據表明Cycloheximide的藥理學窗口更寬,也反映在定性形態學變化中,可以通過CELLCYTE X™生成的高分辨率EC圖像進行識別(圖4)。雖然在1.11 μ M下,兩種藥物在6小時內似乎都不會影響典型的成纖維細胞形態,但在48小時內卻有明顯的差異。使用喜樹堿,可以通過四舍五入的高對比度細胞的形式看到廣泛的細胞死亡。
為了更準確地反映藥物的細胞毒性,用於EC合流定量的掩膜被設置為不識別大量碎片(圖4,右中)。另一方面,Cycloheximide引起的蛋白質合成抑製不僅表現為EC匯合所量化的中度增殖抑製,而且在形態學上表現為高對比度核周結構的廣泛積累(圖4,右下角),這些特征可以通過高分辨率EC圖像來識別。
3. 使用增強型輪廓匯流和熒光通道衡量指標的復合物篩選
前瞻性抗增殖藥物庫的篩選通常通過高通量設置中的分析來完成,其中單個指標反映了在預定終點對細胞健康的不同測量。通過使用CELLCYTE X™的增強輪廓和熒光成像模式,可以使用多種指標實時評估藥物治療對細胞增殖的影響。
為了驗證CELLCYTE X™在合理準確量化細胞增殖方面的能力,我們用廣泛濃度的細胞毒性藥物治療了快速生長的乳腺癌細胞系,並使用儀器的EC和綠色熒光通道對其進行實時成像。組成性表達GFP蛋白的MDA-MB-231細胞用從156nM至20µM的Staurosporine和喜樹堿的1:2稀釋劑量-反應曲線處理。Staurosporine是一種有效的蛋白激酶抑製劑,通過Caspase-3介導的雕亡誘導細胞死亡。
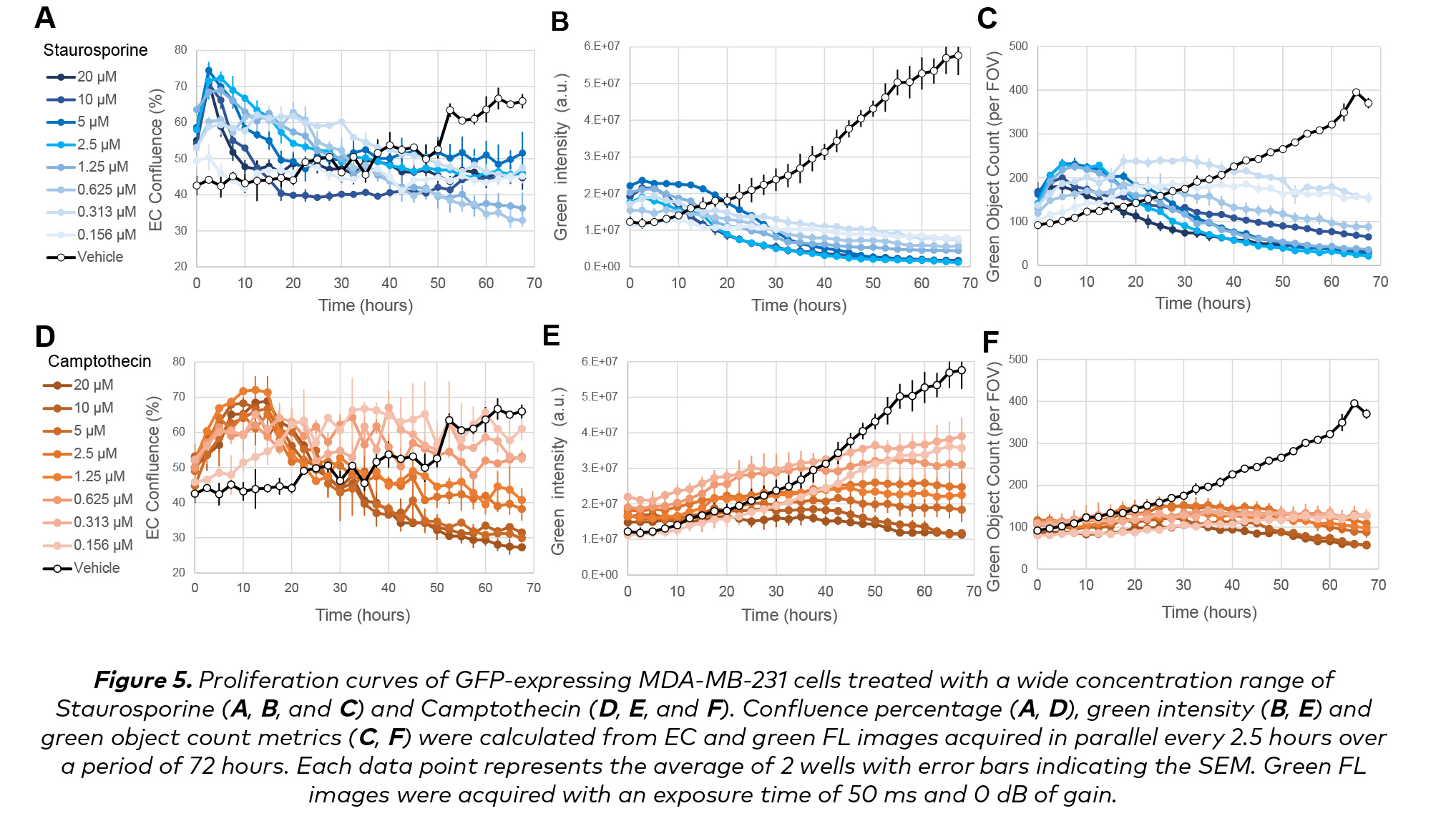
如圖5A和5D所示,Staurosporine和喜樹堿均在6至12小時後達到峰值,隨後在接下來的3天內緩慢但穩定地下降,尤其是在高劑量下。使用CELLCYTE Studio軟件采集和分析熒光圖像,獲得綠色強度(圖5B和5E)和綠色物體計數指標(圖5C和5F。事實上,這兩個參數對這些藥物的效果提供了一個互補的觀點。
Staurosporine處理的細胞(圖5B)的綠色強度反映了GFP的整體表達程度,在最初的6- 12小時內保持不變,並穩步下降,而對照處理的細胞則顯示出6倍的增長。對於喜樹堿,在3個數據中,細胞表現出更微妙的劑量依賴性恒定動力學(圖5E)。第三個感興趣的指標是綠色物體計數,與強度相反,Staurosporine(圖5C)比喜樹堿(圖5F)表現出更顆粒的劑量依賴性行為。
這3個指標提供了一組不同但互補的定量測量,可以通過檢查采集和分析的圖像進行協調。
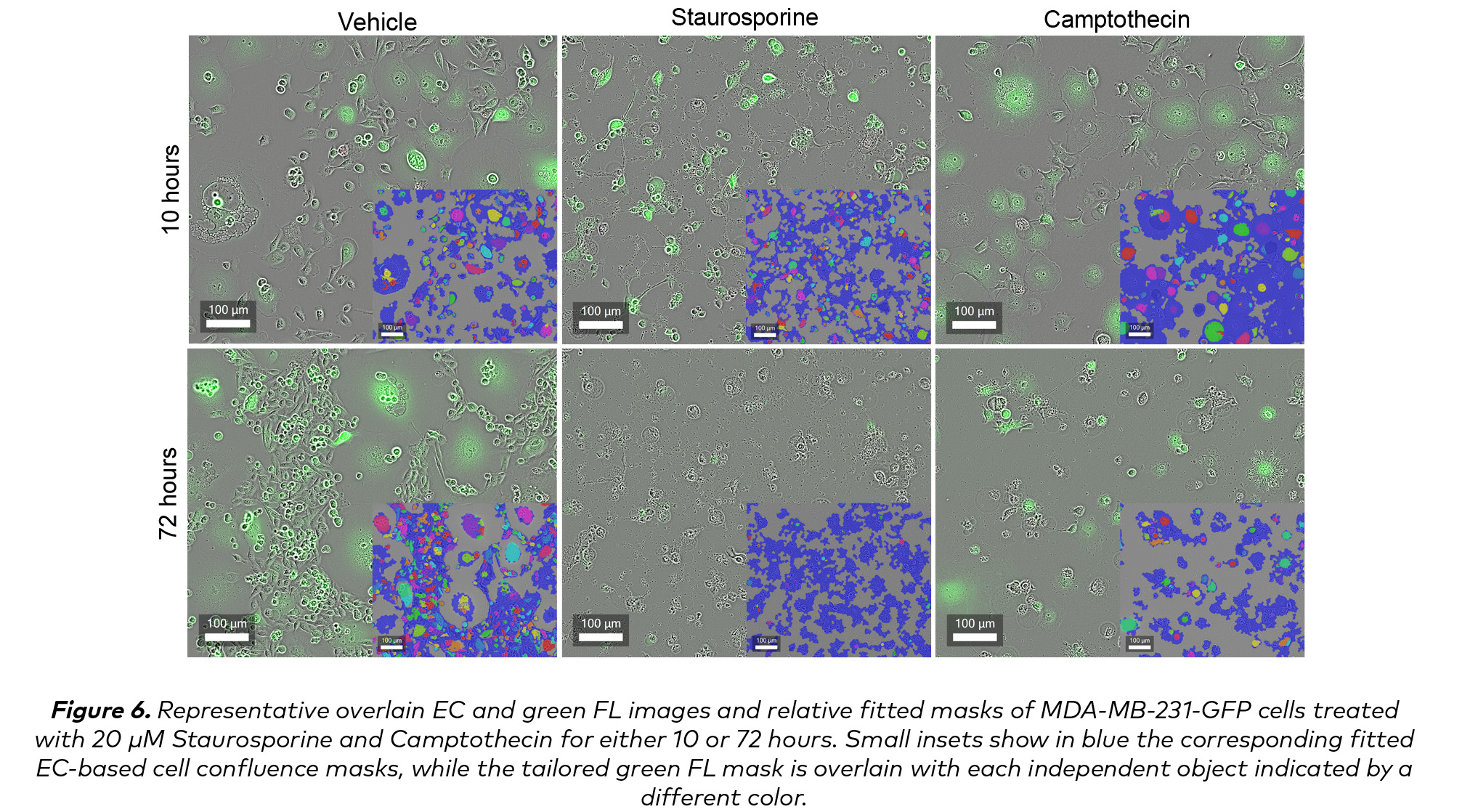
經Staurosporine處理的細胞在10小時後呈現出明顯的星狀形態(圖6)。因此EC -匯流掩膜(圖6)高估了總體占據面積的增加。隨著時間的推移,細胞生長確實受到了抑製,盡管有星形形態,但EC融合度指標仍然可以觀察到廣泛的細胞死亡,該指標描述了前10小時後的穩定下降。
在這種情況下,需要考慮的補充指標是熒光信號。當檢查綠色熒光時,Staurosporine處理的細胞中雕亡小體中GFP的積累解釋了綠色物體數量的增加,如圖5C和圖6所示。在接下來的幾天裏,隨著膜完整性的完全喪失和壞死,熒光物數量以一種更依賴劑量的方式迅速減少,在staurosporin處理的細胞中,72小時後可以看到最小的信號(圖6)。
實驗結論
本研究已經證明,高通量活細胞成像平臺CELLCYTE X™可以為藥理學篩選提供自動化的、連續的動態細胞生長分析:
EC匯合率、細胞核計數和細胞計數用於監測細胞增殖。
多個熒光通道可在共培養系統中進行靈活的細胞增殖分析。
通過定性形態學分析以及EC合流率、熒光強度信號和熒光物計數的定量測量,實現了全面的藥理評價。
參考文獻
1. Lawana V, Korrapati MC, Mehendale HM. Cycloheximide. In Wexler P,ed. Encyclopedia of Toxicology. 3rd ed. Academic Press; 2014: 1103–1105. DOI:10.1016/B978-0-12-386454-3.00298-0.
2. DrugBank Online. Camptothecin. Accessed 12 October 2021. https://go.drugbank.com/drugs/DB04690.
3. Eidet JR, Pasovic L, Maria R, et al. Objective assessment of changes in nuclear morphology and cell distribution following induction of apoptosis. Diagnostic Pathology. 2014; 9(1): 92. DOI:10.1186/1746-1596-9-92.
4. Deshmukh M, Johnson EM. Staurosporine-induced neuronal death: multiple mechanisms and methodological implications. Cell Death & Differentiation. 2000; 7(3): 250–261. DOI:10.1038/sj.cdd.4400641.
5. Yang R, Fu W, Wang S, et al. Mechanism of the morphological changes induced by staurosporine in rat osteoblasts. Calcified Tissue International. 1997; 61: 68–73. DOI:10.1007/s002239900297.
6. Tharanga Jayasooriya R, Gayani Dilshara M, Neelaka Molagoda I,et al. Camptothecin induces G2/M phase arrest through the ATM-Chk2-Cdc25C axis as a result of autophagy-induced cytoprotection: Implications of reactive oxygen species. Oncotarget. 2018; 9(31): 21744–21757.DOI:10.18632/oncotarget.24934.



